Антибиотикорезистентность – устойчивость возбудителей различных инфекционных заболеваний к широкому спектру антибиотиков, т.е. происходит снижение чувствительности патогенной микрофлоры к антибактериальным препаратам. Данная проблема является глобальной для всего человечества. И с каждым днем становится все более сложно бороться с окружающими, и населяющими нас микроорганизмами. Все это связано с такими общеизвестными фактами, как то, что в последние десятилетия не было создано ни одной новой молекулы антибиотиков; фармацевтические предприятия не заинтересованы в разработках других антибиотиков; а также, использование антибиотиков не по назначению – т.е. когда люди сами себе прописывают препараты не зная причину своего недуга и т.д. [1]
Устойчивость микроорганизмов к антибиотикам может быть двух типов: природная и приобретенная. Приобретенная устойчивость заключается чаще всего в синтезе ферментов, которые изменяют или инактивируют антибактериальные средства (бета-лактамазы, ацетилтрансферазы и др.). Отсутствие у микроорганизма мишени, на которую непосредственно влияет антибиотик, выражает его природную устойчивость. Наиболее быстро вырабатывают устойчивость к используемым в настоящее время антибиотикам стафилококки, пневмококки и т.д. [2].
В связи с растущей проблемой антибиотикорезистентности многие ученые и исследователи пытаются разработать другие эффективные средства отличные от антибиотиков, которые бы имели аналогичное или даже превышающее их бактерицидное действие. В качестве таких средств могут быть использованы экстракты лекарственных растений, металлы и другое. Но, например, многие лекарственные растения обладающие хорошими ранозаживляющими, затягивающими свойствами, не имеют выраженного бактерицидного действия, что не может быть использовано для прекращения развития патогенных микроорганизмов в ране. А цинковая мазь, в состав которой входит только оксид цинка и вазелин, обладает помимо адсорбирующего, подсушивающего действия, еще и антисептическое. Т.е. использование эссенциальных элементов в составе антимикробных препаратов для предотвращения развития инфекции является открытой областью, которую необходимо тщательно изучить [2–3].
Таким образом, все эти средства – антибиотики, экстракты лекарственных растений, эссенциальные металлы – использующиеся по отдельности сейчас, могут быть применены для создания высокоэффективного бактерицидного, ранозаживляющего препарата путем совмещения их действий.
В следствие этого, целью нашего исследования является изучение бактерицидного действия солей, в состав которых в качестве катиона выступает эссенциальный элемент – цинк, по отношению к пробиотическим, патогенным и условно-патогенным щтаммам микроорганизмов (рисунок).
В качестве объектов исследования были использованы такие штаммы микроорганизмов, как четыре пробиотических препарата на основе бактерий рода Bacillus: Споробактерин (B. subtilis 534), Ветом 1.1 (B. subtilis 10641), Ветом 3 (B. amyloliquefaciens 10642), Ветом 4 (B. amyloliquefaciens 10643), условно-патогенные микроорганизмы: Escherichia coli, Micrococcus luteus, Staphylococcus aureus, а также патогенный штамм: Pseudomonas aeruginosa. В качестве бактерицидных факторов в работе использовались сульфат цинка (ZnSO4), нитрат цинка(Zn(NO3)2) и ацетат цинка (Zn(СH3COO)2).
1 2 3
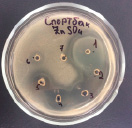
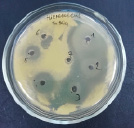
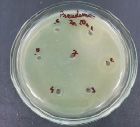
4 5 6
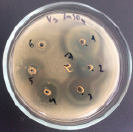
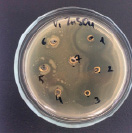
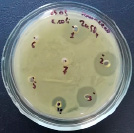
Влияние ZnSO4 на рост исследуемых микроорганизмов: 1 – B. subtilis 534; 2 – M. luteus; 3 – P. aeruginosa; 4 – B. amyloliquefaciens 10642; 5 – B. subtilis 10641; 6 – E. coli
Для оценки биотоксичности солей цинка использовали метод агаровых лунок, выбор данного метода объясняется тем, что он позволяет не только качественно, но и количественно оценить влияние химических соединений на рост анализируемых микроорганизмов [4].
Методика выполнения заключается в следующем: изучаемый микроорганизм высевали сплошным «газоном» на поверхность агаровой пластинки (1,5 % МПА) в чашке Петри. После этого, пробочным сверлом (диаметр 5 мм) вырезали агаровые блочки, при этом на одной чашке Петри можно разместить до 7 агаровых лунок в которые в последующем вносили исследуемые концентрации веществ для оценки их ингибирующего и субингибирующего эффекта. Чашки помещали в термостат на 24 часа при температуре 37°С. После инкубирования производили визуальную оценку действия исследуемого металла на рост популяции. Отсутствие зон подавления роста свидетельствовало о отсутствии влияния либо соли в целом (как правило данное явление отмечалось у солей с низки уровнем диссоциации), либо определенной концентрации. В том случае если исследуемое вещество обладало высокой бактерицидной активностью в отношении исследуемого микроорганизма регистрировали значительные зоны подавления роста вокруг лунки [5].
Данные, представленные на рисунке, показывают, что высокие концентрации катионов цинка оказывают выраженный бактерицидный эффект как в отношении пробиотических штаммов, так и в отношении патогенных и условно-патогенных штаммов микроорганизмов. Т.е. наблюдается прямая зависимость между концентрацией химического вещества и зоной подавления роста микроорганизма, по мере снижения концентрации уменьшается диаметр зоны подавления вплоть до ее отсутствия. Обобщенные данные по изучению влияния солей цинка на исследуемые микроорганизмы представлены в таблице.
Оценка влияния солей цинка на рост исследуемых микроорганизмов
|
Исследуемые микроорганизмы |
ZnSO4, мг/мл |
||||||
|
1148 |
574 |
287 |
143,5 |
71,75 |
35,875 |
17,9375 |
|
|
B. subtilis 534 |
27,4 ± 0,6782 |
22,6 ± 0,6782 |
21 ± 0,5477 |
17 ± 1,3038 |
11,2 ± 2,8178 |
7,4 ± 2,1587 |
– |
|
B. subtilis 10641 |
31,6 ± 0,6782 |
21,6 ± 1,7204 |
17,6 ± 1,9899 |
22,8 ± 1,3928 |
16,8 ± 4,2356 |
– |
– |
|
B. amyloliquefaciens 10642 |
34 ± 1,1402 |
23,8 ± 1,3565 |
19 ± 1,1402 |
17,2 ± 0,6633 |
12,2 ± 0,6633 |
9,4 ± 1,1225 |
– |
|
B. amyloliquefaciens 10643 |
34,6 ± 2,9257 |
31,4 ± 2,9086 |
29,2 ± 2,8531 |
25,8 ± 3,2156 |
19,4 ± 4,9558 |
20,4 ± 5,1245 |
12,6 ± 3,7762 |
|
S. aureus |
30,8 ± 0,3742 |
27 ± 0,3162 |
23,2 ± 0,7348 |
18 ± 0,5477 |
14 ± 0,8366 |
9,4 ± 0,7483 |
– |
|
E. coli |
23 ± 0,5477 |
20,6 ± 0,4 |
17,6 ± 0,6782 |
13,4 ± 0,7483 |
6,2 ± 2,6344 |
– |
– |
|
P. aeruginosa |
22,8 ± 0,8602 |
18,4 ± 0,5099 |
13 ± 0,5477 |
10 ± 0,3162 |
8,6 ± 0,2450 |
– |
– |
|
M. luteus |
38,2 ± 1,2806 |
32,6 ± 0,87178 |
28 ± 1,3038 |
19 ± 0,7072 |
13 ± 0,5477 |
– |
– |
|
Zn (CH3COO)2, мг/мл |
|||||||
|
812 |
406 |
203 |
101,5 |
50,75 |
25,375 |
12,6875 |
|
|
B. subtilis 534 |
26 ± 1,4142 |
23,8 ± 1,1136 |
22 ± 1,0955 |
16,8 ± 0,6633 |
12,6 ± 0,6782 |
12,4 ± 1,4353 |
– |
|
B. subtilis 10641 |
29,6 ± 0,2449 |
23,4 ± 1,2249 |
17,2 ± 2,1307 |
15,2 ± 5,5533 |
– |
– |
– |
|
B. amyloliquefaciens 10642 |
29,8 ± 0,8 |
23,2 ± 0,5831 |
21 ± 0,7071 |
16,2 ± 0,5831 |
13 ± 0,8944 |
12,6 ± 0,8124 |
– |
|
B. amyloliquefaciens 10643 |
32,4 ± 1,7493 |
30,6 ± 0,8718 |
29 ± 0,8367 |
26,8 ± 1,0198 |
19,8 ± 5,0139 |
13,2 ± 5,4718 |
10 ± 4,0866 |
|
S. aureus |
27,8 ± 0,2 |
23,4 ± 0,8178 |
19,2 ± 0,9695 |
12 ± 0,3162 |
7 ± 0,3162 |
– |
– |
|
E. coli |
21,2 ± 0,7348 |
18,4 ± 0,8124 |
14,4 ± 0,5099 |
7,8 ± 2,1071 |
– |
– |
– |
Окончание табл.
|
Zn (CH3COO)2, мг/мл |
|||||||
|
812 |
406 |
203 |
101,5 |
50,75 |
25,375 |
12,6875 |
|
|
P. aeruginosa |
16,2 ± 0,5831 |
12,8 ± 0,3742 |
10,6 ± 0,5099 |
7,4 ± 1,8601 |
– |
– |
– |
|
M. luteus |
32,8 ± 0,8602 |
30,8 ± 0,7350 |
24 ± 0,4472 |
17,6 ± 1,2083 |
11,4 ± 1,0296 |
– |
– |
|
Zn(NO3)2, мг/мл |
|||||||
|
1188 |
594 |
297 |
148,5 |
74,25 |
37,125 |
18,5625 |
|
|
B. subtilis 534 |
26,4 ± 1,6309 |
23,8 ± 1,3565 |
21 ± 0,6325 |
18 ± 0,3162 |
13 ± 0,8944 |
8,8 ± 2,2226 |
– |
|
B. subtilis 10641 |
28,4 ± 0,9274 |
22 ± 1,0488 |
16,4 ± 0,4 |
25 ± 2,7928 |
14,6 ± 6,005 |
– |
– |
|
B. amyloliquefaciens 10642 |
28,8 ± 0,5831 |
23,2 ± 0,2 |
19,4 ± 0,6782 |
16,2 ± 0,5831 |
13 ± 0,8944 |
12,6 ± 0,8124 |
– |
|
B. amyloliquefaciens 10643 |
34,6 ± 0,6782 |
25,2 ± 6,4141 |
29,2 ± 1,2 |
27,4 ± 1,7205 |
23,6 ± 0,8124 |
21 ± 0,6325 |
– |
|
S. aureus |
27,8 ± 0,6633 |
23,6 ± 0,9274 |
18,6 ± 0,6782 |
12,6 ± 1,6309 |
9,2 ± 0,8 |
5,4 ± 1,3638 |
– |
|
E. coli |
22,2 ± 0,4899 |
18,2 ± 0,8 |
17 ± 0,5477 |
9,4 ± 0,6782 |
4 ± 1,7029 |
– |
– |
|
P. aeruginosa |
20,8 ± 0,4899 |
15,8 ± 0,7348 |
12,2 ± 0,3742 |
10,6 ± 0,4 |
8,6 ± 0,2449 |
– |
– |
|
M. luteus |
35,4 ± 0,5099 |
31,8 ± 0,4890 |
23,6 ± 0,6 |
18,4 ± 0,6782 |
14,2 ± 0,3742 |
– |
– |
При исследовании влияния анионных компонентов цинка на пробиотические, патогенные и условно-патогенные штаммы были получены следующие результаты. Исследования показывают о достаточно выраженном токсическом влиянии всех исследуемых солей цинка не зависимо от анионного компонента в отношении изучаемых микроорганизмов. Но следует отметить, что наиболее выраженным токсическим эффектом в отношении микроорганизмов S. aureus, E. coli, P. aeruginosa, M. luteus обладает сульфат цинка, однако значения зон подавления роста, которого, незначительно превысили значения ацетата и нитрата цинка для изучаемых штаммов. Данная зависимость также наблюдается и в отношении пробиотических штаммов (B. subtilis, 534 B. subtilis 106,4 B. amyloliquefaciens 10642,1 B. amyloliquefaciens 10643)
Также было установлено, что в отношении нитрата, сульфата и ацетата цинка наиболее устойчивым оказался патогенный штамм P. aeruginosa.
Библиографическая ссылка
Русяева М.Л., Филончикова Е.С., Сизенцов Я.А. ИЗУЧЕНИЕ ВЛИЯНИЯ СОЛЕЙ ЦИНКА НА РОСТ ПРОБИОТИЧЕСКИХ, ПАТОГЕННЫХ И УСЛОВНО-ПАТОГЕННЫХ ШТАММОВ МИКРООРГАНИЗМОВ // Научное обозрение. Педагогические науки. 2019. № 5-2. С. 79-82;URL: https://science-pedagogy.ru/ru/article/view?id=2173 (дата обращения: 24.01.2026).


 science-review.ru
science-review.ru