Луковичные растения – красивоцветущие декоративные растения, которые издавна использовались для озеленения. К наиболее популярным декоративным растениям формирующим луковицы относятся тюльпаны, нарциссы, лилии, рябчик и др. В данной статье мы рассматриваем введение в культуру in vitro двух видов луковичных растений – Рябчик бледноцветковый и Зефирантес.
Рябчик бледноцветковый (Fritillaria pallidiflora) относится к семейству Liliaceae, достаточно высокорослый азиатский вид, достигающий в высоту до 40–50 см. Листья относительно крупные, до 2 см в ширину, матово-зеленые, собраны в мутовки. Стебель с большим числом листьев, из верхней пазухи которых в мае появляются 3–9 желтоватых цветков с зеленым рисунком внутри, похожих по форме на крупные колокольчики. В зависимости от разновидности, их цвет может быть также сметанно-белым или зеленовато-желтым [1]. Луковицы рябчика широко используют в китайской, тибетской и корейской традиционной медицине. Содержащиеся в луковицах растений алкалоиды, в малых дозах, оказывают лечебное действие, а в больших дозах – опасны для здоровья. В китайской медицине на основе содержащихся в луковицах алкалоидов изготавливают отхаркивающие и успокаивающие средства. Для любителей альпинариев рябчики являются красивыми декоративными растениями, а для аборигенов Камчатки их луковицы служили источником пищи. Чешуи луковиц сушили, нанизывали на веревки и продавали индейцам, которые называли их северо-западным рисом. В Казахстане из луковиц рябчика бледноцветкового делают средство, которое применяется при лечении гипертонии [2].
Зефирантес (Zephyranthes rosea) – род цветковых растений семейства Амариллисовые (Amaryllidaceae), некоторые виды используются как комнатные растения. Родиной растений рода Зефирантес являются тропические и субтропические регионы Северной, Центральной и Южной Америки. Название рода означает в переводе с греческого «цветок Зефира» (Zephyr– имя бога западного теплого ветерка и anthes – цветок). Этому экзотическому растению на родине дали название «дождевой лилий», так как она начинает цвести с началом сезона дождей. В народе это растение называют «выскочкой» из-за того что как луковица выпускает стрелку, так на ней сразу же распускается бутон [3, 4]. В народной медицине луковицу зефирантеса используют при абсцессах (в горячих компрессах), заболеваниях печени. Все растение зефирантеса белого применяется при конвульсиях и гепатите. В разных странах препараты зефирантеса используют для лечения рака, диабета, туберкулеза, при простуде [5].
В естественных условиях произрастания, а также в интродукции скорость вегетативного размножения данных растений невысока, и от одной луковицы можно получить только две за год. Такой низкий потенциал не позволяет размножать виды луковичных растений традиционным делением луковицы. Семенное воспроизводство очень длительное и составляет в среднем 3 – 5 лет. Размножение в условиях in vitro является эффективным и альтернативным способом воспроизведения данных растений и позволяет получить болшое количество растений в короткие сроки [6]. В связи с этим нами начаты исследования по размножению луковичных растений Зефирантесиз сем. Amaryllidaceaeи исчезающего вида – Рябчик сем. Liliaceae и в условиях in vitro.
Материалы и методы исследования
Объектами исследования служили Рябчик бледноцветковый Fritillaria pallidiflora из семейства Liliaceae и Зефирантес розовый Zephyranthes rosea из семейства Amaryllidaceae. Оба вида относятся к луковичным растениям. В качестве исходного материала (экспланта) использовали отрезки пазушных почек, донца луковицы (видоизмененный стебель) и луковичных чешуй данных растений.
Для введения в культуру invitro исходные экспланты стерилизовали в следующих дезинфицирующих растворах: 70 % этанол и 0,5 % гипохлорит натрия. Этапы стерилизации растительного материала для получения стерильных эксплантов:
1) почистить растение от грязи;
2) помыть мыльной водой;
3) прполоскать проточной водой; 4) простерилизовть этонолом 70 %-м – 5 мин;
5) простерилизовать раствором гипохлорита натрия 0,5 %-м – 7–10 мин;
6) промыть дистиллированной водой 3–5 раз.
После стерилизации экспланты: чешуи, пазушные почки, донце луковицы разрезали на мелкие отрезки, которые помещали на питательную среду Мурасиге и Скуга (МС) [7] с разным соотношением фитогормонов. Использовали среды МС, содержащие 6–бензиламинопурин (БАП) и нафтилуксусную кислоту (НУК) в следующих соотношениях: 10,0 мг/л БАП и 1,0 мг/л НУК; 2,5 мг/л БАП и 0,5 мг/л НУК. Полученные растения-регенеранты поместили в закрытую чашку с небольшим колличеством воды на неделю, при этом воду меняли каждый день. Затем растения переместили в заранее подготовленный грунт.
Результаты исследования и их обсуждение
Стерилизация эксплантов 0,5 %-м раствором гипохлорита натрия (7 мин.), 70 % раствором этанола (5 мин.) и трехкратным промыванием в дистиллированной воде с последующим высушиванием на стерильной фильтровальной бумаге показала выскокий процент стерильности высаженных эксплантов (70–80 %).
Каллусогенез луковичных растений в культуре ткани in vitro. На всех испольованных нами эксплантах через 3 недели было обнаружено образование каллусных тканей. Характеристика каллусных тканей: гетерогенные каллусы беловато-прозрачного цвета с иголчатыми выступами на поверхности ткани (рис. 1).
В культуре пазушных почек, использованных в качестве экспланта, частота каллусогенеза составила – 84,6 % на питательной среде МС с фитогормонами в соотношении 10,0 мг/л БАП и 1,0 мг/л НУК. Из чешуек луковицы частота каллусогенеза составила – 46,6 % на аналогичной среде. На среде МС, содержащего фитогормоны в соотношении 2,5 мг/л БАП и 0,5 мг/л НУК, индукция каллусных тканей из отрезков зеленых пазушных почек составила – 100 % (таблица).
Таким образом, нами установлено, что для индукции каллусогенеза наиболее подходящими эксплантами являются зеленые пазушные почки растений и оптимальной питательной средой для каллусогенеза из пазушных почек являются среды МС содержащие фитогормоны в соотношении 10,0 мг/л БАП и 1,0 мг/л НУК и МС 2,5 мг/л БАП и 0,5 мг/л НУК, где частота каллусообразования составила 100 % и 84,6 %, соответственно. Для эксплантов из чешуек наиболее оптимальной оказалась среда МС с добавлением 10,0 мг/л БАП и 1,0 мг/л НУК, где частота каллусогенеза составила – 46,6 %.
а б

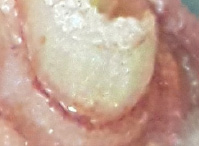
Рис. 1. Каллусогенез луковичных растений: а – из зеленых пазушных почек луковичных растений; б – из луковичных чешуй
Влияние компонентов питательной среды на каллусогенез и морфогенез
|
Варианты сред |
Количество посаженных эксплантов, шт |
Каллусогенез |
Прямая регенерация |
|||||||||
|
Общее количество эксплантов |
Зеленые пазушные почки |
Чешуи |
Донце |
Зеленые пазушные почки |
Чешуя |
Чешуя |
Донце |
|||||
|
шт |
% |
шт |
% |
шт |
% |
шт |
% |
|||||
|
МС с 10,0 мг/л БП и 1,0 мг/л НУК |
31 |
13 |
15 |
3 |
11 |
84,6 |
7 |
46,6 |
2 |
13,3 |
3 |
100 |
|
МС с 2,5 мг/л БАП и 0,5 мг/л НУК |
20 |
8 |
12 |
– |
8 |
100 |
– |
– |
– |
– |
– |
– |
Регенерация растений в культуре in vitro. Через 4 недели на тканевых культурах при культивировании на свету при освещенности 1,5 тыс лк наблюдали образование побегов и выход растений-регенерантов. Из двух использованных вариантов питательных сред для регенерации растений среда МС с 10,0 мг/л БАП и 1,0 мг/л НУК оказалась оптимальной. На этой среде прямая регенерация растений из отрезков чешуек составила 3,3 %, из отрезков донца луковицы – 100 %. Наиболее удачной оказалась среда МС с 10,0 мг/л БАП и 1,0 мг/л НУК, на которой через 4 недели наблюдалась прямая регенерация растений изэксплантов (отрезков чешуи и донца) (рис. 2).
Таким образом, наиболее оптимальной для регенерации растений из луковичных растений оказалась среда МС с добавлением фитогормонов 10,0 мг/л БАП и 1,0 мг/л НУК. Для получения растений-регенерантов удобными эксплантами являются отрезки донца луковицы, так как из кусочков донца в условиях in vitro достигнута 100 % регенерация растений.
а б

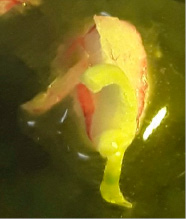
Рис. 2. Регенерация растений у луковичных: а – прямая регенерация растений из отрезков донца луковицы; б – регенерация из отрезков чешуи
Полученные результаты экспериментов показывают, что способ размножения луковичных растений в условиях in vitro с использованием в качестве эксплантов отрезков донца луковиц, является наиболее приемлемым способом размножения луковичных растений, который дает эффективный результат.
Научные руководители: Амирова Айгуль Кузембаевна, Лесова Жаниха Туреевна.
Библиографическая ссылка
Алимбай А.Б., Амирова А.К., Лесова Ж.Т. КУЛЬТИВИРОВАНИЕ IN VITRO ЛУКОВИЧНЫХ РАСТЕНИЙ // Научное обозрение. Педагогические науки. 2019. № 5-2. С. 7-10;URL: https://science-pedagogy.ru/ru/article/view?id=2156 (дата обращения: 02.02.2026).


 science-review.ru
science-review.ru