Полимеразная цепная реакция (ПЦР) – экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК/РНК) в биологическом материале (пробе).
Многочисленные открытия в области молекулярной биологии и генетики способствовали открытию ПЦР.В 1869 г. И. Мишер выделил вещество из клеток гноя, которое содержало азот и фосфор. Изначально вещество назвали нуклеином, а когда были определены его кислотные свойства нуклеиновой кислотой.В 1944 г. были проведены эксперименты по трансформации бактерий учеными О. Эвери, К. Маклауда и М. Маккарти. В ходе этих экспериментов было доказано, что за трансформацией бактерий (приобретением болезнетворных свойств безвредной культурой в результате добавления в неё убитых кипячением болезнетворных бактерий) стоит выделенная из пневмококков ДНК.В 1952 г. учеными А. Херши и М. Чейзом был проведен эксперимент с помеченными радиоактивными изотопами ДНК и белками. В результате они выяснили, что в зараженную клетку передается только нуклеиновая кислота, а не белок, как считалось ранее.В 1949–1951 гг. были сформулированы «правила Чаргаффа». Группа биохимика Э. Чаргаффа установила количественное соотношение между различными типами азотистых оснований в составе нуклеотидов ДНК.
Правила Чаргаффа и данные рентгеноструктурного анализа Розалинд Франклин сыграли решающую роль в расшифровке структуры ДНК. На основе этих данных в 1953 году Дж. Уотсоном и Ф. Криком был установлен принцип комплементарности. Ученые сделали вывод о том, что ДНК представляет собой двойную полипептидную цепь, образующую спираль благодаря водородным связям между азотистыми основаниями (аденин-тимин и гуанин-цитозин).В 1955 г. произошло открытие фермента ДНК-полимераза А. Корнбергом. Этот фермент способен удлинять полипептидную цепь присоединяя к 3’-концу цепи ДНК дополнительный нуклеотид. Для этого необходимо, чтобы праймер связался с цепью ДНК (матрицей) по принципу комплементарности. Чтобы реакция прошла раствор должен содержать нуклеозидтрифосфаты (дНТФ), которые используются в качестве «строительного материала». В 1971 г. Клеппе с соавторами определили состав реакционной смеси, и принципы использования ДНК-праймеров для получения новых копий ДНК. Однако, из-за технологической сложности искусственного синтеза праймеров и нестабильности реакции, метод ПЦР было невозможно использовать на практике в полной мере.В 1975 г. Т. Брок и Х. Фриз открыли Thermusaquaticus (грамотрицательную палочковидную экстремально термофильную бактерию). А в 1976 г. была выделена Taq-полимераза – фермент, который способен работать при повышенных температурах (оптимум 72–80°C).В 1983–1984 гг. К. Мюллисом был проведен ряд экспериментов по разработке ПЦР. Ученый первый начал использовать вместо ДНК-полимеразы устойчивую к высоким температурам Taq-полимеразу, что позволило ускорить работу по разработке полимеразной цепной реакции. Кроме того, К. Мюллисом в соавторстве с Ф. Фалуном был разработан алгоритм циклических изменений температуры в ходе ПЦР.
Открытие метода ПЦР стало одним из наиболее выдающихся событий в области молекулярной биологии за последние десятилетия. Метод продолжает развиваться, появляются новые модификации, но мы предлагаем рассмотреть методику проведения классической ПЦР.
Методика полимеразной цепной реакции
Метод постановки ПЦР требует наличия в реакционной смеси ряда основных компонентов: праймеры, Taq-полимераза, смесь дезоксинуклеотидтрифосфатов, буфер, анализируемый образец.
Праймеры – искусственно синтезируемые олигонуклеотиды, как правило, размером от 15 до 30 нуклеотидов, которые идентичны соответствующим участкам ДНК-мишени. Играют ключевую роль в амплификации, образуя продукты реакции.
Для полимеразной цепной реакции последовательности праймеров очень важны, потому что реакционный цикл имеет определенные величины температур, используемые на этапах нагрева и охлаждения.
Кроме того, большой избыток праймеров в реакционной смеси ПЦР приводит к тому, что они с большей вероятностью сталкиваются с частично комплементарным праймером, чем с полностью комплементарной ДНК матрицой. Таким образом, следует избегать комплементарностипраймеров друг другу.
Taq-полимераза – термостабильный фермент, который обеспечивает достраивание З’-конца второй цепи ДНК по принцип комплементарности. Этот фермент довольно часто используется при проведении стандартной ПЦР.
Taq ДНК полимераза имеет оптимальную температуру репликации – 75–80°C и выдерживает длительное воздействие температур до 96°C. Таким образом, она может оставаться активной после каждого из шагов денатурации.
Смесь дезоксинуклеотидтрифосфатов (дНТФ) – «строительный материал», который используется Taq-полимеразой для синтеза второй цепи ДНК. Включает в себя дезоксиаденозинтрифосфат (дАТФ), дезоксигуанозинтрифосфат (дГТФ), дезоксицитозинтрифосфат (дЦТФ) и дезокситимидинтрифосфат (дТТФ).
Для оптимального включения оснований в синтезируемую цепь ДНК их обычно добавляют к реакционной смеси ПЦР в эквимолярных количествах. Как правило, конечная концентрация каждого дезоксинуклеозидтрифосфата составляет 0,2 мМ.
Буфер – смесь катионов и анионов используемая в определенной концентрации, обеспечивающая оптимальные условия для реакции, а также стабильное значение рН. Значение рН буфера колеблется от 8,0 до 9,5 и стабилизируется Трис-HCl.
Одним из компонентов буфера Taq-полимеразы является ион калия (KCl), который способствует отжигу праймеров. Буферная концентрация ионов магния является еще одним важным фактором для правильного функционирования ДНК-полимеразы. Ионы магния служат кофактором для ДНК полимеразы.
Анализируемый образец – вносимый в реакционную смесь препарат, обычно содержащий искомую ДНК, служащую мишенью для амплификации. В случае отсутствия ДНК-мишени продукт не образуется.
Иногда для удобства детекции или контроля эффективности в состав реакционной смеси могут быть внесены дополнительные компоненты.
Внутренние контроли – несвойственный данному организму фрагмент ДНК, как правило, большего размера, ограниченный специфическими праймерами. Практически представляет собой альтернативную матрицу ПЦР и позволяет контролировать эффективность амплификации в каждой конкретной пробирке.
ДНК-зонды – искусственно синтезированные олигонуклеотиды небольшого размера (около 30 нуклеотидов), комплементарные специфическим ампликонам (продуктам реакции). Могут использоваться для детекции продуктов ПЦР, благодаря прикрепленным к ним изотопным или флуоресцентным меткам.
Для улучшения результатов ПЦР используются различные ПЦР добавки. Эти компоненты способны понижать температуру денатурации матрицы или стабилизируют ДНК-полимеразу.
Обычно используемые ПЦР-добавки включают диметилсульфоксид (ДМСО), сульфат аммония, полиэтиленгликоль, бычий сывороточный альбумин (BSA), желатин, N-триметилглицин и глицерин.
Если в пробе имеется искомая ДНК, с ней происходит ряд последовательных цикличных реакций, которые различаются температурными режимами.
Ход реакции
Амплификация может включать в себя множество циклов, но все они состоят из трёх этапов: денатурация, отжиг, элонгация [1].
Денатурация – процесс перехода двухнитевой формы ДНК в однонитевую из-за разрыва водородных связей между комплементарными парами оснований при воздействии высоких температур.
Отжиг – процесс присоединения праймеров к одноцепочечной ДНК-мишени. Отжиг происходит благодаря правилу комплементарностиЧаргаффа. Без соблюдения этих условий праймеры не отжигаются.
Элонгация (синтез). Taq-полимераза достраивает вторую цепь ДНК с 3’-концапраймера.
Температура в реакционной смеси доводится до оптимума работы Taq-полимеразы. Затем она максимально эффективно начинает синтезировать вторую цепь ДНК от 3’-конца праймера, который связан с матрицей, и продвигается в направлении от 3’ к 5’ концу.
Результатом ПЦР будет экспоненциальное увеличение количества специфического фрагмента ДНК, описываемое формулой
А = М(2n – n–1)~2n,
где А – количество специфических (ограниченных праймерами) продуктов реакции амплификации; М – начальное количество ДНК-мишеней; n – число циклов амплификации.
Таким образом, специфические фрагменты, ограниченные на концах праймерами, впервые появляются в конце второго цикла, накапливаются в геометрической прогрессии и очень скоро начинают доминировать среди продуктов амплификации.
Виды ПЦР
Помимо классического варианта ПЦР существует также множество других вариантов постановки ПЦР, которые направлены на решение многих задач: увеличение эффективности реакции и снижения риска образования неспецифических продуктов; реализацию возможности проведения качественного и количественного анализа искомых участков молекулы ДНК/РНК [2].
В клинико-диагностических лабораториях наиболее распространенными модификациями ПЦР являются:
ПЦР с «горячим» стартом (hot-start PCR) – суть этой модификации состоит в предотвращении возможности начала реакции до момента достижения условий, которые обеспечивают специфический отжиг праймеров.
В момент постановки ПЦР полимеразная активность фермента блокируется антителами или небольшими молекулами типа Affibody, имитирующими антитела, до наступления первой денатурации (при 95°C в течение 10 минут).
ПЦР с «горячим» стартом дает возможность минимизировать вероятность образования неспецифических продуктов ПЦР и возможность получения ложноположительных результатов анализа.
ПЦР с обратной транскрипцией (ОТ-ПЦР, RT-PCR) – предназначен для амплификации, выделения или идентификации последовательности РНК. Сперва проводят синтез одноцепочечной молекулы ДНК (кДНК), с помощью ревертазы (обратной транскриптазы), используя для матрицы мРНК. Затем образовавшуюся кДНК используют для последующей ПЦР.
Возможность использовать РНК в качестве мишени для ПЦР расширяет спектр применения метода, например, геномы многих вирусов (гепатит С, вирусы гриппа, ВИЧ и т.д.) представлены именно РНК.
ПЦР с анализом результатов «по конечной точке» (End-point PCR) – эта модификация позволяет учитывать результаты реакции по наличию флуоресценции после амплификации, не открывая пробирку. Таким образом, решается проблема контаминации ампликонами. Однимизвариантовявляетсяметод «FLASH» (FLuorescentAmplification-basedSpecificHybridization – специфическая гибридизации в процессе амплификации с ДНК-зондами, меченными флуорофорами).
ПЦР в режиме «реального времени» (Real-Time PCR, ПЦР-РВ) – используется одновременно для амплификации и измерения количества искомой молекулы ДНК. Преимущество состоит в возможности совмещения детекции и количественного определения специфической последовательности ДНК в образце после каждого цикла амплификации в реальном времени.
Для этого используются флуоресцентные красители, которые интеркалируют в двуцепочечные молекулы ДНК или модифицированные дезоксинуклеоты, флуоресцирующие после гибридизации с комплементарными участками ДНК.
Мультиплексная (мультипраймерная) ПЦР – амплификация двух и более последовательностей ДНК в одной пробирке одновременно. Преимущество этого метода заключается в возможности выявления ряда патогенов, генетических модификаций организмов или генотипирования множественных аллелей и т.д., поместив проб в одну пробирку.
Все перечисленные виды ПЦР не могут быть проведены без необходимого пространства и оборудования.
Организация ПЦР-лаборатории и необходимое оборудование
Организация ПЦР-лаборатории и необходимый список оборудования регламентированы Методическими указаниями (МУ 1.3.2569–09) «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I–IV групп патогенности». Комплект необходимого оборудования для проведения ПЦР должен включать в себя все необходимые приборы для выделения НК, их амплификации и детекции результатов. Все оборудование должно быть исправным, иметь технический паспорт и инструкцию по эксплуатации. Все приборы должны соответствовать нормам безопасности.
Для предотвращения контаминации исходных образцов используют одноразовые пробирки с плотно закрывающимися крышками и наконечники к микродозаторам, термостаты с твердотельнымтермоблоком, специальные контейнеры для сброса использованных наконечников и пробирок. Смена наконечников является обязательной после каждой проведенной манипуляции [3].
Для каждого отдельного помещения предусмотрено наличие холодильников и морозильников для поддержания определенной температуры, вортексов и ротаторов для перемешивания, центрифуг различной мощности для перемешивания и разделения образцов. Также необходимо наличие комплекта дозаторов различного диапазона объемов и подходящих для них наконечников, штативов для микропробирок, самих микропробирок (центрифужных, градуированных и пр.) различных объемов. Все комнаты должны быть оснащены бактерицидными рецикуляторами для дезинфекции воздуха при помощи УФ, все рабочие поверхности и наружные поверхности корпусов приборов должны быть устойчивы к дезинфекции. Помимо перечисленного списка каждая зона лаборатории должны содержать конкретный набор приборов, необходимых для выполнения соответствующих задач.
Организация зон лаборатории представлена на схеме [4].
Зона приема, регистрации и первичной обработки материала должна быть оборудована центрифугами для осаждения и разделения компонентов проб.
В зоне выделения НК необходимо наличие:
• абактериального бокса для защиты исследователя от патогенных агентов, передающихся воздушно-капельным путем;
• процессора магнитных частиц для экстракции НК;
• нанофотометра для определения количества и качества выделенной из образка ДНК/РНК;
• термостата для поддержания постоянной температуры в пробирках, помещенных в гнезда термоблока;
• дистиллятора для получения дистиллированной воды.
• Зона приготовления реакционной смеси и проведения ПЦР должна содержать:
• амплификатор, необходимый для нагрева/охлаждения пробирок;
• бокс для стерильных работ для обеспечения защиты от контаминации при выделении ДНК и подготовке реакционной смеси.
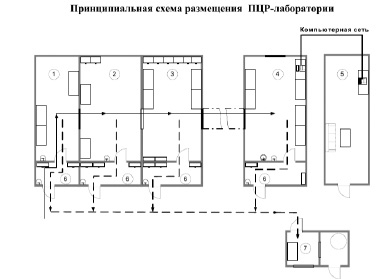
Обозначения:
1 – зона приема, разбора и первичной обработки материала;
2 – зона подготовки проб и выделения НК;
3 – зона приготовления реакционных смесей, проведения ОТ и ПЦР;
4 – зона детекции результатов методом электрофореза и ГиФА;
5 – комната анализа результатов;
6 – предбокс;
7 – комната обеззараживания материала.

Обязательными для зоны детекции результатов являются:
• камера для электрофореза – разделения продуктов амплификации нуклеиновых кислот, а также источник питания, преобразующий переменный ток в постоянный;
• система гель-документации для регистрации результатов и воспроизведения электрофореграмм, включающая в себя трансиллюминатор для детекции результатов в УФ спектре, а также компьютер;
• электронные прецизионные весы для приготовления агарозного геля, который используется при электрофорезе;
• электрическая плитка для тех же целей.
В последней, но немаловажной зоне дезинфекции материалов необходим паровой стерилизатор для обработки образцов водяным паром под давлением.
Состав оборудования может варьировать в зависимости от размера лаборатории и других факторов.
Заключение
Метод ПЦР находит применение в различных областях диагностики. Его применяют для выявления в клинических образцах вирусов, бактерий, простейших, а также для обнаружения приобретенных и врожденных генетических нарушений и идентификации личности [5].
Автоматизация этапов денатурации, отжига и элонгации с применением современного оборудования позволяет упростить проведение анализа и способствует его широкому применению в различных областях диагностики. Однако повсеместное внедрение данного метода ограничивается необходимостью ручной и трудоемкой подготовки проб идетекции результатов, а также необходимостью в оснащенной лаборатории со всеми необходимыми реактивами и оборудованием.
Сфера применения полимеразной цепной реакции в дальнейшем будет расширяться, т.к. все чаще в клинической практике имеют дело с очень небольшим количеством исследуемого материала, анализ которого возможен только этим методом.
Появление все новых видов ПЦР способствует охвату большего спектра возможностей для применения метода, упрощает и ускоряет его проведение, тем самым позволяя получить наиболее точный, верный и быстрый результат.
Библиографическая ссылка
Колотова А.А., Васильева О.Ю., Горошко П.В. ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ КАК МЕТОД ИССЛЕДОВАНИЯ В МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКЕ // Научное обозрение. Педагогические науки. 2019. № 5-2. С. 46-51;URL: https://science-pedagogy.ru/ru/article/view?id=2165 (дата обращения: 07.01.2026).


 science-review.ru
science-review.ru