Открытие новых элементов Периодической системы всегда вызывало интерес широкой публики. С древних времен и по сегодняшний день открыто 118 химических элементов. В природе встречаются элементы с атомными номерами (т.е. количеством протонов), не превышающими 92 (U – уран, атомный номер 92). Элементы с количеством протонов от 93 до 100 можно получить в реакторах, а свыше 100 – на ускорителях частиц.
Рассмотрим последние 4 элемента, которые получены в XXI веке и зарегистрированы Международным союзом теоретической и прикладной химии (ИЮПАК). В настоящее время новые элементы получают на ускорителях тяжелых ионов. В нашей стране, начиная с 1950 г., работа по их синтезу на ускорителях тяжелых ионов ведется в городе Дубна, как его еще называют Наукоград.
Тяжелыми ионами, ускоренными в циклотронах или линейных ускорителях, бомбардируют мишени из тяжелых элементов, и в результате реакции слияния с испусканием одного или нескольких нейтронов синтезируется новый элемент с порядковым номером, соответствующим сумме зарядов ядер налетающего иона и ядра мишени (рисунок).
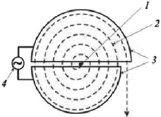
Устройство циклотрона: 1. Место поступления частиц. 2. Траектория их движения. 3. Электроды. 4. Источник переменного напряжения (магнитное поле направленно перпендикулярно плоскости рисунка)
Образующиеся ядра далее претерпевают радиоактивный распад. Для синтеза наиболее устойчивых изотопов выбирают такие комбинации ядер, в которых содержится по возможности большое число нейтронов, а составные ядра имеют низкую энергию возбуждения. Выход получаемых тяжелых элементов чрезвычайно мал – отдельные атомы или десятки атомов, иногда за месяцы облучения на ускорителе [1]. Период полураспада – время, в течение которого распадается половина радиоактивных ядер. Эта величина является константой для данного радиоактивного ядра (изотопа), наглядно характеризующей скорость распада радиоактивных ядер.
Новые элементы Периодической системы Д.И. Менделеева
Нихоний (лат. Nihonium, Nh) – химический элемент 7-го периода III группы. Атомный номер – 113. Атомная масса наиболее устойчивого из известных изотопов с периодом полураспада 20 с составляет 286,182 а.е.м. Искусственно синтезирован, радиоактивен, в природе не встречается. Сначала нихоний был синтезирован в Российской Федерации методом горячего слияния в Объединённом институте ядерных исследований (ОИЯИ) в Дубне. Почти в то же время появилась информация о синтезе данного элемента в Японии методом холодного слияния. Дальнейшие исследования по синтезу сто тринадцатого элемента велись в различных лабораториях по всему миру, однако японские научные работники из RIKEN достигли более внушительных результатов, и по этой причине ИЮПАК признал приоритет открытия за японцами.
Отечественные ученые предложили 113-ый элемент назвать Беккерелий в честь Анри Беккереля, который открыл явление радиоактивности. Жители страны Восходящего солнца рекомендовали целый ряд названий: Японий, Нисинаний (в честь физика Ёсио Нисина) и Рикений (в честь института RIKEN) [2, c. 222]. Однако, Международный союз теоретической и прикладной химии рекомендовал наименование «Нихоний» (от яп. Нихон коку – Япония, дословно «страна восходящего солнца»). 28 Ноября 2016 г. сто тринадцатый элемент таблицы Менделеева приобрёл официальное название, перестав именоваться Унунтрием.
Нихоний относится к подгруппе бора, следуя в ней после таллия (табл. 1). Нихоний по некоторым предположениям является тяжёлым непереходным металлом с расчётной плотностью 16 г/см3. Как и все металлы подгруппы бора (начиная с алюминия), он должен быть крайне легкоплавок. Расчётная температура плавления нихония 425 °C (несколько выше tпл. таллия = 303.6 °C) [3]. Предполагается, что нихоний значительно менее реакционноспособен, чем таллий, и станет более похож не на него, а на металлы побочной подгруппы I группы – медь или серебро. Всему виной релятивистские эффекты взаимодействия первого 7р1 электрона с двумя 7s2 электронами, которые увеличивают энергию ионизации нихония вплоть до 704,9 кДж/моль, что значительно больше энергии ионизации таллия 589,4 кДж/моль.
Таблица 1
Пятая группа химических элементов
|
Название элемента |
Атомная масса |
Плотность, г/см3 |
tпл., °C |
tкип,. °C |
Агрегатное состояние |
|
Бор (B) |
10.811 |
2.34 |
2075.8 |
3926 |
Твердое |
|
Алюминий (Al) |
26.9815 |
2.69 |
660 |
2518 |
Твердое |
|
Галлий (Ga) |
69.723 |
5.91 |
29.8 |
2202 |
Твердое |
|
Индий (In) |
114.818 |
7.31 |
156.2 |
2080 |
Твердое |
|
Талий (Tl) |
204.383 |
11.85 |
303.6 |
1473 |
Твердое |
|
Нихоний (Nh) |
286.182 |
≈ 16 |
≈ 425 |
≈ 1155 |
Твердое |
Нихоний обладает самым сильным сродством к электрону из числа всей подгруппы бора (0,64 эВ). По этой причине он может являться не только восстановителем, но и окислителем, в отличие от всех предыдущих элементов.
Степень окисления нихония +1, вероятно, как и у таллия, будет более стабильной, но различия от химии таллия крайне внушительны. Предполагается, что гидроксид нихония, в отличие от гидроксида таллия, будет слабым основанием, свободно разлагающимся вплоть до Nh2O. Помимо степеней окисления −1 и +1 этот элемент может проявлять степени окисления +2, +3 и даже +5, что противоречит номеру группы. Однако, дальнейшее окисление нихония осуществляется не с помощью 7s2 электронов, которые разорвать весьма трудно, а за счёт 6d10 электронной оболочки. Поэтому степень окисления +5 будет относительно нестабильной [3].
Московий (лат. Moscovium, Mc) – химический элемент 7-го периода V группы. Атомный номер – 115. Атомная масса наиболее устойчивого из известных изотопов с периодом полураспада 156 мс составляет 289,194 а.е.м. Искусственно синтезирован, радиоактивен, в природе не встречается. Московий был открыт вместе с нихонием нашими соотечественниками из ОИЯИ путем горячего слияния, в результате которого образовывался атом 117 элемента (Ts – теннессин), и, как результат радиоактивного распада, получались атом нихония и атомы московия [2, c. 222]. В 2013 году международная категория экспертов в области физики из Лундского университета (Швеция) доказала существование изотопа Московия в результате исследования, согласно которому происходит бомбардировка тонкой пленки америция ионами кальция. Вследствие этого получилось 30 атомов московия. В 2015 году этот же эксперимент провели в Национальной лаборатории имени Лоуренса в Беркли, получив 46 атомов московия. 30 Декабря 2015 года ИЮПАК официально признал открытие 115-го элемента, и преимущественная заслуга в этом учёных из ОИЯИ и Ливерморской национальной лаборатории. 8 Июня 2016 года ИЮПАК рекомендовал дать элементу название «московий» (Moscovium, Mc) в честь Московской области, где находится Объединённый институт ядерных исследований (Дубна).
Предполагается, что московий – непереходный металл, похожий на висмут. Плотность его предполагается около 13,5 г/см3, что больше плотности свинца и несколько меньше плотности ртути (табл. 2). Расчётная температура плавления московия предполагается около 400 °С, то есть он должен быть менее легкоплавким, чем висмут. Московий принадлежит к подгруппе азота и располагается после висмута [3].
Таблица 2
Шестая группа химических элементов
|
Название элемента |
Атомная масса |
Плотность, г/см3 |
tпл., °C |
tкип., °С |
Агрегатное состояние |
|
Азот (N) |
14.0067 |
0.001251 |
-209.9 |
-195.8 |
Газообразное |
|
Фосфор (P) |
30.9737 |
2.82 |
44.15 |
281.85 |
Твердое |
|
Мышьяк (As) |
74.9216 |
5.72 |
816.8 |
613 |
Твердое |
|
Сурьма (Sb) |
121.760 |
6.69 |
630.7 |
1587 |
Твердое |
|
Висмут (Bi) |
208.9804 |
9.8 |
271.4 |
1560 |
Твердое |
|
Московий (Mc) |
289.194 |
≈ 13.5 |
≈ 400 |
≈ 1200 |
Твердое |
В отличие от более лёгких элементов, которые проявляют окислительные свойства, ослабевающие от азота к висмуту, московий химически ожидается похожим больше не на более лёгкие аналоги своей подгруппы, а на щелочные металлы, проявляя большое сходство с таллием. Как и щелочные металлы, московий будет обладать весьма низкой энергией ионизации первого электрона, которая составит 538 кДж/моль, что практически равно энергии ионизации лития и немного больше таких же значений для натрия. Основные свойства усилит очень большой размер катиона, что сделает McOH сильным основанием, подобным KOH или NaOH. Московий будет быстро окисляться на воздухе кислородом или азотом, бурно реагировать с водой с выделением водорода и образовывать прочную ионную связь с галогенами. Степень окисления московия может быть +3 в соединениях, похожих на соли висмута в степени окисления +3. Однако, соединения со степенью окисления московия +3 могут быть получены только в относительно жёстких условиях с некоторыми сильными кислотами [3].
Теннессин (лат. Tennessine, Ts) – химический элемент 7-го периода VII группы. Атомный номер – 117. Атомная масса наиболее устойчивого из известных изотопов с периодом полураспада 78 мс составляет 294,210 а.е.м. Искусственно синтезирован, радиоактивен, в природе не встречается. В начале 2009 г. руководитель ОИЯИ в Дубне академик Юрий Оганесян информировал о том, что его лаборатория готова синтезировать 117-ный элемент, место которого в таблице Менделеева пустует. Для синтеза 117-го элемента необходима мишень из берклия. Его должны создать в достаточном количестве, а это около 30 мг американские ученые из Национальной лаборатории в Окридже. Но сама сложность исследования заключается в том, что период полураспада берклия 320 дней, и эксперимент необходимо проводить в кратчайший срок, т.к. атомы берклия могут разложиться [2, c. 222].
После получения материала в НИИ атомных реакторов в г. Димитровграде из берклия сделали мишень, которую в дальнейшем отправили в Дубну. Так как на момент синтеза элемента № 117 были открыты элементы № 116 и № 118, то с экспериментом трудностей не должно было возникнуть, потому что ученые представляли какими свойствами будет обладать элемент. В апреле 2010 г. было сообщено об успешном итоге исследований: после двух экспериментов, каждый из которых длился 70 дней, было получено шесть атомов теннессина. Полученные его изотопы имеют сравнительно большую устойчивость (7 и 31 мс), что подтверждает теорию о существовании острова стабильности в области сверхтяжелых ядер, которую разработал и развил Юрий Цолакович Оганесян. Для его исследования необходимо синтезировать еще более тяжелые ядра атомов [2, c. 222]. В 2014 г. открытие элемента подтверждено группой из немецких учёных. Им удалось синтезировать 4 атома элемента № 117 и проследить цепочку их радиоактивного распада, в результате был зафиксирован также неизвестный ранее изотоп 103-го элемента лоуренсия. В январе 2016 г. ИЮПАК официально назвал первооткрывателями элемента 117 команду российских и американских ученых (Дубна-Ливермор), которые предложили дать ему постоянное название «теннессин» и символ «Ts».
Он относится к галогенам, следуя после йода и астата. Точные его свойства пока не известны и являются предметом обсуждения. Наиболее вероятно он является полуметаллом, в котором металлические свойства преобладают над неметаллическими. Его плотность находится в пределах от 7,0 – 7,3 г/см3, чуть больше, чем у его гомолога астата. При комнатной температуре он должен оставаться твердым, температура плавления колеблется в пределах от 300 до 500 °С, а температура кипения около 550 °С (табл. 3) [3]. Все элементы VII группы проявляют окислительные свойства, которые уменьшаются от фтора к астату.
Таблица 3
Седьмая группа химических элементов
|
Название элемента |
Атомная масса |
Плотность, г/см3 |
tпл., °C |
tкип., °C |
Агрегатное состояние |
|
Фтор (F) |
18.9984 |
0.001696 |
-219.7 |
-188.1 |
Газообразное |
|
Хлор(Cl) |
35.453 |
0.003214 |
-100.9 |
-34.55 |
Газообразное |
|
Бром (Br) |
79.904 |
3.14 |
-7.3 |
58.8 |
Жидкость |
|
Иод (I) |
126.904 |
4.94 |
113.5 |
184.4 |
Твердое |
|
Астат(At) |
209.9871 |
6.4 |
230 |
302 |
Твердое |
|
Теннессин (Ts) |
294.210 |
≈ 7.0 – 7.3 |
≈ 300 |
≈ 550 |
Твердое |
Теннессин, следуя после астата, почти не проявляет окислительной способности ввиду большого удаления электронов от ядра и, скорее всего, он станет первым галогеном, чьи восстановительные свойства будут преобладать над окислительными.
По этой же причине степень окисления -1 возможна только с очень сильными восстановителями [3]. Теоретически возможны в жестких условиях степени окисления +3 и +5, т.к. требуется разрушение электронной оболочки 7р5 .
Оганесон (лат. Ogannesson, Og) – химический элемент 7-го периода VIII группы. Атомный номер – 118. Атомная масса наиболее устойчивого из известных изотопов с периодом полураспада 1 мс составляет 294,214 а.е.м. Искусственно синтезирован, радиоактивен, в природе не встречается. Первое упоминание 118-го и 116-го элементов произошло ещё в 1999 г. в Беркли (США) и оказалось ошибочным и даже фальсифицированным. Элемент № 118 был получен в 2002 г. группой физиков–ядерщиков под руководством Ю.Ц. Оганесяна совместно со специалистами Ливерморской национальной лаборатории. Они провели первую официально подтверждённую серию успешных экспериментов, в ходе которой было зафиксировано рождение атома и его распад. 17 октября 2006 г. отечественные и американские физики – ядерщики официально сообщили о получении 118-го элемента [2, c. 222]. В январе 2016 г. ИЮПАК официально признал первооткрывателями элемента № 118 команду российских и американских ученых и предложил название «Оганесон» в честь академика Ю.Ц. Оганесяна, под чьим руководством было синтезировано более десяти сверхтяжелых элементов [4].
По своим свойствам он может обладать большей химической активность по сравнению с предыдущим инертным газом в связи с его меньшей энергией ионизации (табл. 4). Более электроотрицательные элементы могут окислять оганесон до степени окисления +2 и +4. Он сможет образовывать относительно стабильные соединения и с менее электроотрицательными элементами.
Таблица 4
Восьмая группа химических элементов
|
Название элемента |
Атомная масса |
Плотность, г/см3 |
tпл., °C |
tкип., °C |
Агрегатное состояние |
|
Гелий (He) |
4.0026 |
0.00017646 |
-272.2 |
-268.9 |
Газообразное |
|
Неон (Ne) |
20.1797 |
0.0009002 |
-248.6 |
-246.1 |
Газообразное |
|
Аргон (Ar) |
39.948 |
0.001784 |
-189.3 |
185.85 |
Газообразное |
|
Криптон (Kr) |
83.798 |
0,003749 |
-156.6 |
-152.3 |
Газообразное |
|
Ксенон (Xe) |
131.293 |
0.005894 |
-111.9 |
-107 |
Газообразное |
|
Радон (Rn) |
222.0176 |
0.0098 |
-71 |
-61.8 |
Газообразное |
|
Оганесон (Og) |
294.214 |
≈ 5 |
≈ 95 |
? |
Жидкое |
Интересное исследование провели ученые из Новой Зеландии и США. Результаты квантово-химических расчетов позволили считать оганессон уникальным элементом. Логично считать, что, если оганессон относится к группе инертных газов, следовательно, он имеет на вешнем энергетическом уровне 7s27p6 электронов. Тем не менее, химики – теоретики доказали, что электроны, вращающиеся вокруг ядра, теряют свою оболочную структуру и превращаются в «электронный газ» [5]. Согласно расчётам, эффект размытия электронных оболочек постепенно увеличивается вместе с ростом заряда атома (чем больше порядковый номер, тем больше размытие). Следуя этому выводу, оганессон – не инертный газ. Так, после заполнения 7 периода следует 8 период со своими новыми элементами, которые в корне будут отличатся от предыдущих. Это объясняется тем, что в 8 периоде появится новый g-подуровень, на котором могут находиться ещё 18 новых элементов.
В заключении можно сказать, что когда-то Периодическая таблица Менделеева Д.И. будет полностью сформирована, т.к., согласно расчетам Назаревича [6], в этой таблице может быть 172 элемента. При этом протоны и нейтроны в ядре будут прочно удерживаться сильными взаимодействиями, способствующими стабилизации ядер.
Библиографическая ссылка
Лях С.С., Тлехусеж М.А. ИСТОРИЯ ОТКРЫТИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ СЕДЬМОГО ПЕРИОДА В XXI ВЕКЕ // Научное обозрение. Педагогические науки. 2019. № 4-4. С. 68-72;URL: https://science-pedagogy.ru/ru/article/view?id=2146 (дата обращения: 27.02.2026).


 science-review.ru
science-review.ru