Одним из основных свойств интерполимерных комплексов (ИПК) и поликомплексных композитов (ПКК) полученных на базе натрийкарбоксиметилцеллюлозы (Na-КМЦ) и мочевиноформальдегидного олигомера (МФО) являются совместимость составляющих взаимодействующих компонентов. Совместимость в данной системе определяется, главным образом, по их средней свободной энергии смешения. Свободная энергия смешения можно определить сорбционными свойствами полученного ИПК и их составляющих компонентов [1].
Сорбционные свойства интерполимерных комплексов и поликомплексных композитов на основе Na-КМЦ и МФО, а также составляющих их компонентов исследовались с помощью сорбционной установки, описанной в работе [2]. Толщина пленок для сорбционных исследований составляла 60-80 мкм. Интегральные теплоты растворения и набухания индивидуальных исходных полимеров и их смесей в воде измеряли с помощью дифференциального автоматического микрокалориметра ДАК-1-1А.
На рис. 1 представлены изотермы сорбции паров воды поликомплексов Na-КМЦ и МФО и исходного продукта Na-КМЦ. Из рис. 1 видно, что наибольшей сорбционной способностью обладает исходный продукт Na-КМЦ а меньшие значение по сравнению Na-КМЦ имеет поликомплекс стехиометрического состава Na-КМЦ-МФО. Такой характер изменение сорбционной способности обусловлена, по-видимому, уплотнением структуры поликомплексов и ростом плотности упаковки макромолекул, состоящих из цепей различных по химической природе полимерных компонентов, и их сродством друг к другу, а также к растворителю. Именно такое положение и соответствующее этому изотерме будет точно отражать сложный механизм сорбции, а именно, связанной с химическим строением молекул сорбата и сорбента, а также гибкостью цепей и структурой сорбента. Эта подтверждается данными об изменении структуры продуктов ПК и ПКК, полученные методами электронной микроскопии [3] и набухания [4].
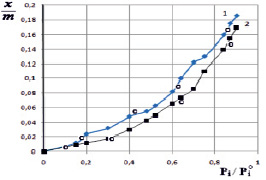
Рис. 1. Изотермы сорбции паров воды полимерами Na-КМЦ (1) и поликомплекса Na-КМЦ-МФО (2): – экспериментальные точки;  – рассчитанные на основе уравнения ТОЗМ
– рассчитанные на основе уравнения ТОЗМ
Известно [1], что процесс адсорбции на микропористых системах протекает по механизму объемного заполнения. Поэтому изотермы адсорбции описаны уравнениями теории объемного заполнения микропор (ТОЗМ). Используя положения ТОЗМ и обобщая экспериментальные данные, пришли к выводу о возможности применения функции распределения Вейбула в качестве функции распределения адсорбционного объема по значению потенциала для описания адсорбции на поликомплексах. Применительно к распределению степени заполнения по адсорбционному потенциалу функцию распределения Вейбула представляют соотношением:
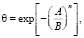 (1)
(1)
где Е и n – параметры, не зависящие от температуры. Величина Е называется характеристической энергией адсорбции. Показатель степени n выражается целыми числами в зависимости от структуры адсорбента. А – работа адсорбции, т.е. работа переноса 1 моль газа с поверхности жидкого адсорбата (давление P0i) в равновесную газовую фазу (давление Pi):
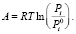 (2)
(2)
Степень заполнения адсорбента можно представить как отношение величины адсорбции 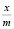 к максимальной адсорбции
к максимальной адсорбции 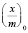 . Тогда из уравнения (1) получим:
. Тогда из уравнения (1) получим:
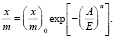 (3)
(3)
Уравнение (3) является общим уравнением ТОЗМ. В логарифмическом виде оно имеет линейную форму:
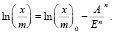 (4)
(4)
В ряде работ авторов [5, 6], были рассмотрены случаи распределения микропор в зависимости от различных факторов. При этом было и высказано предположение о целесообразности применения как двухчленного, так и трехчленного уравнения ТОЗМ.
Изотермы адсорбции для исследуемых нами образцов можно описать одночленным уравнением ТОЗМ:
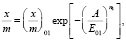 (5)
(5)
где 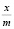 – величины адсорбции в моль/г,
– величины адсорбции в моль/г, 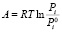 – работа адсорбции в кДж/моль. Изотерма адсорбции воды на Na-КМЦ и Na-КМЦ-МФО рассчитанные по ТОЗМ приведены на рис. 1. Для системы вода – Na-КМЦ параметры уравнения (5) равны:
– работа адсорбции в кДж/моль. Изотерма адсорбции воды на Na-КМЦ и Na-КМЦ-МФО рассчитанные по ТОЗМ приведены на рис. 1. Для системы вода – Na-КМЦ параметры уравнения (5) равны: 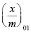 = 0,186 моль/г, Е01 = 1,787 кДж/моль, n1 = 1 и уравнение ТОЗМ примет вид:
= 0,186 моль/г, Е01 = 1,787 кДж/моль, n1 = 1 и уравнение ТОЗМ примет вид:
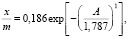 (6)
(6)
а для поликомплекса Na-КМЦ–МФО: 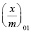 = 0,603, моль/г, E01 = 0,25 кДж/моль,
= 0,603, моль/г, E01 = 0,25 кДж/моль, 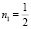 и уравнение ТОЗМ:
и уравнение ТОЗМ:
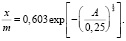 (7)
(7)
На основании полученных данных (рис. 1), можно заключить, что расчетные данные в хорошей согласии с экспериментальными (где  – экспериментальные точки, а
– экспериментальные точки, а  – рассчитанные на основе уравнения ТОЗМ). Кроме того, следует указать, что вода исследуемых системах распределяется на поверхности однородно и показывает уплотнение структуры поликомплекса, а в случае Na-КМЦ – структура уплотняется за счет водородных связей.
– рассчитанные на основе уравнения ТОЗМ). Кроме того, следует указать, что вода исследуемых системах распределяется на поверхности однородно и показывает уплотнение структуры поликомплекса, а в случае Na-КМЦ – структура уплотняется за счет водородных связей.
Нами была рассчитана по данным сорбции воды гомополимерами и поликомплексом по уравнению, предложенной А.А. Тагером [1], средняя свободная энергия смешения (Δgx), минимальное значение который соответствует интерполимерному комплексу (рис. 2).
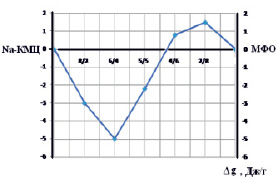
Рис. 2. Зависимость средней свободной энергии смешения (Δgx) от состава поликомплекса Na-КМЦ-МФО
По результатам измерения теплоты набухания были рассчитаны средние значения энтальпии смешения ΔHx используя следующего уравнения:
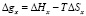 (8)
(8)
при этим вычислены энтропия смешения поликомплекса Na-КМЦ-МФО которые равны ΔHx = –24 Дж/моль и TΔSx = –18,7 Дж/моль.
Таким образом, результаты термодинамических свойств свидетельствуют, что комплексообразование Na-КМЦ-МФО сопровождается отрицательными изменениями смешения. Это является весьма важным условием термодинамической совместимости полимеров, свидетельствующей об образовании водородных и электростатических связей между функциональными группами взаимодействующих компонентов.
Библиографическая ссылка
Орифов Д.М., Инагамов С.Я., Мурадов С.С., Олимов Х.К. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА ИНТЕРПОЛИМЕРНЫХ КОМПЛЕКСОВ НА ОСНОВЕ НАТРИЙКАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ // Научное обозрение. Педагогические науки. 2019. № 2-4. С. 102-105;URL: https://science-pedagogy.ru/ru/article/view?id=2048 (дата обращения: 09.03.2026).


 science-review.ru
science-review.ru