Занимая первое место по смертности, онкологические заболевания являются одной из малоизученных угроз существования человечества, поражая ткани человека на уровне клетки, поэтому изучение механизма клеточных часов и временной соотнесённости метаболизма в клетках, а также возможности воздействия на него позволят разработать новые более эффективные подходы в борьбе с этой болезнью.
Все живые организмы внутри клеток имеют собственные часы, которые посредством воздействия, в первую очередь, света, а также в зависимости от регулярности поступления пищи и физической активности (рис. 1) устанавливают с внешней средой прочную связь и подстраивают под неё физиологические и биохимические процессы как на клеточном, так и на организменном уровне [1]. Такое эволюционное приспособление возникло для упрощения скоординированной работы клеток организма в соответствии с окружающими условиями и позволяет значительное время обходиться без света, сохранив прежние ритмы. Например, достаточно сильное ощущение чувства голода перед обедом и чувство дискомфорта даже при небольших изменениях в часовых поясах [2].
Различают центральные часы, расположенные в супрахиазматическом ядре гипоталамуса, и периферические, расположенные в клетках всех других органов и тканей, в разной степени зависимые и по-разному отсроченные от центральных при помощи нейрогуморальной регуляции [3]. Ритмы образуются при ежедневном повторяющемся каждые 24 часа взаимодействии компонентов молекулярных часов, включающих основную, дополнительную и регуляторную петли обратной связи (рис. 2) [3]. Однако сложная организация и разная чувствительность органов к определённым стимулам могут стать причиной ряда патологий, включая онкологические заболевания [4, 5].
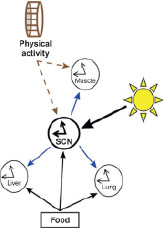
Рис. 1. Основные синхронизаторы клеточных часов с внешней средой [2]
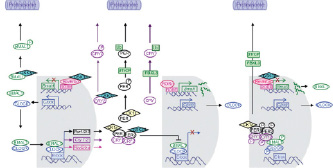
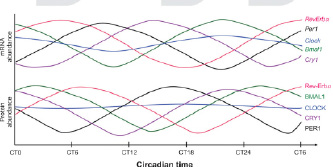
Рис. 2. Суточные превращения компонентов клеточных часов от пробуждения (CT0) до полудня следующего дня (CT6) для дневного животного в естественных условиях [2]
У пациентов с дезорганизацией клеточного метаболизма во времени отмечается высокий риск возникновения онкологических заболеваний и быстрого метастазирования, снижение эффективности противоракового лечения и выживаемости [5]. Одним из стимулов запуска раковых процессов может стать поздний хронотип – хроническое и наиболее опасное нарушение циркадных ритмов, результатом которого являются эрозии слизистой желудочно-кишечного тракта, постоянный стрессовый фактор и ожирение, по своей природе являющиеся деструктивными состояниями для человека, способными не только значительно повысить вероятность, но и стать первопричиной ракового заболевания [5–11].
Важное место в риске развития онкологических заболеваний с чувствительность организма к определённому фактору внешней среды. Например, у слабовидящих людей периферические часы гораздо более автономны от центральных часов, реагирующих на свет, поэтому у них отмечается гораздо меньший риск возникновения рака [12].
На сегодняшний день выявлены прямые связи белков циркадных ритмов с возникновением и протеканием ряда онкологических заболеваний, в частности, с онкогенными вирусными инфекциями [6, 9, 12]. Например, между вирусом герпеса и убиквитин-специфической протеазой (HAUSP). Выявлено ингибирующее действие белков PER на убиквитин-лигазу MDM2 E3 водителя рака р53 и убиквитирующая стимуляция белков CRY на водитель рака c-MYC (рис. 3) [6, 8]. Другим примером является высокая корреляция между рецидивами у пациентов с раком молочной железы и поздним хронотипом [6, 9].
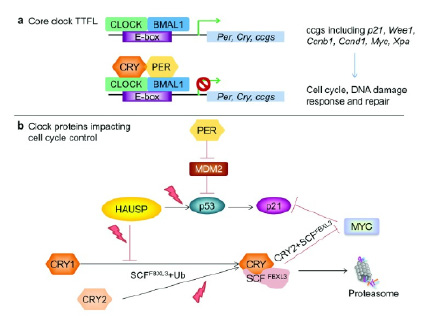
Рис. 3. a – образование белков клеточных часов семейств PER и CRY по принципу отрицательной обратной связи, b – связь этих белков с онкогенным действием вируса герпеса человека [6]
Выявлены механизмы связывания ДНК с помощью белков основной петли CLOCK и механизмы включения белком PER1 репаративных ферментов при двухцепочечных разрывах ДНК [9]. Выявлена роль белка BMAL1 в предотвращении колоректального рака, обусловленного воздействием ?-излучения. Белок Per1 обладает функцией подавления опухоли, в то время как Per2 усиливает пролиферацию патологических клеток у больных с раком молочной железы [9, 12].
Как правило, онкологические заболевания предполагают нарушения в работе циркадных ритмов на клеточном уровне в тканях (до 12 часов разницы), а также на системном уровне, широко распространены нарушения сна, несмотря на это даже на поздней стадии волны пролиферативной активности опухоли не дезорганизованы во времени и могут варьировать в зависимости от типа ткани и опухоли [6, 9]. Так как уже исследованы взаимосвязи многих видов рака человека и млекопитающих и изменения активности соответствующих компонентов клеточных часов и связанных с ними метаболических датчиков и рецепторов, противораковая терапия может предусматривать подавление роста опухоли путём воздействия цитотоксических веществ на клетки в момент клеточной пролиферации, тем самым повышая эффективность лечения [6].
Таким образом, нарушения циркадного ритма играют важнейшую роль в развитии и течении онкологических заболеваний. Хочется верить, что все те накопленные хронобиологические знания, мы сможем применять как в диагностике той или иной формы рака, так и для эффективного и, главное, своевременного лечения онкологических заболеваний.


 science-review.ru
science-review.ru