Микроскопия – это изучение объектов и элементов чрезвычайно малых размеров. Человеческий глаз имеет предел разрешения и детализации таких объектов, диктуемый его природными свойствами. Для преодоления этого биологического ограничения используются различные приборы-микроскопы. На сегодняшний день, одним из ведущих методов исследования микрообъектов в биологических науках является оптическая (она же световая) микроскопия. Световые микроскопы являются важнейшими инструментами как при проведение некоторых рутинных медицинских анализов, так и в биологических и медико-биологических научных исследованиях. Они незаменимы при изучении морфологических свойств микробиологических объектов, к которым относятся насекомые и их части, многие паразиты, клетки растений и животных, простейшие и бактерии. Возможность изучения топографии, морфологии, ультраструктуры позволило человеку значительно расширить свои знания о микроорганизмах. В медицине, микроскопы позволяют проводить подсчёт клеток крови, анализ биопсий на структуру, морфологию и наличие определённых включений. С применением молекулярно-биологических техник, появилась возможность выявить локализацию отдельных химических веществ.
Сущность оптических методов
Современная световая микроскопия обеспечивает увеличение до 2–3 тысяч раз, что является достаточным для изучения различных форм жизни на клеточном уровне и других биологических объектов [1, 2]. Основными характеристиками любого микроскопа являются разрешающая способность и контраст. Разрешающая способность – минимальное расстояние, на котором находятся две точки, различаемые как раздельные объекты. Контраст –возможность различать объекты и отдельные детали от их фона. Если различие в яркости объекта и фона составляет менее 3 – 4 %, то его невозможно различить, даже если оптика микроскопа теоретически способна разрешить его детали. На контраст влияют как свойства объекта, которые изменяют световой поток по сравнению с фоном, так и способности оптики прибора уловить возникающие различия в свойствах луча. Главным ограничением для возможностей светового микроскопа является волновая природа света, которое не позволяет увидеть объекты, размеры которых сопоставимы с волновой длиной электромагнитного излучения светового диапазона, т.е. меньше 1 микрометра.
Для различных нужд создаются оптические системы различной конструкции [3, 4]:
Прямой микроскоп является наиболее часто встречаемой конструкцией. Такая схема используется чаще всего при изучение прозрачных и полупрозрачных микрообъектов размеров, сопоставимых с клетками. Лабораторные микроскопы особенно широко применяются в различных областях биологии (ботанике, микробиологии, цитологии) и медицины (обычно это микробиологический и гистологический анализ материала).
Инвертированная схема микроскопа отличается от прямой тем, что в ней объективы находятся не над, а под исследуемым предметом. Это позволяет оптимизировать конструкцию инструмента для работы с достаточно большими по своему объему объектами, вроде флаконов для культивирования клеток. В зависимости от назначения и особенностей конструкции, инвертированные микроскопы могут быть биологическими, люминесцентными, металлографическими и др. Подобные приборы широко используются при различных научных и лабораторных исследованиях в микробиологии и медицине.
Стереоскопические или стереомикроскопы имеют в своей конструкции два расположенных под углом объектива, и благодаря этому позволяют получать стереоскопическое изображение исследуемого объекта. Стереомикроскопы обладают существенно большей глубиной резкости, чем обычные, что позволяет использовать их для изучения относительно крупных и выпуклых микрообъектов – таких как части растений, грибов, колонии микроорганизмов. Выделяют два типа конструкции световых микроскопов: схема Грену и оптическая система с общим главным объективом.
Вариации микроскопии
Светлопольная микроскопия
Светлопольная микроскопия позволяет исследовать объекты в проходящем свете в светлом поле [2,5]. Данный вид микроскопии предназначен для исследования морфологии, размеров клеток, их взаимного расположения, структурной организации клеток и других особенностей. У светового микроскопа максимальная разрешающая способность составляет 0,2 мкм, что обеспечивает высокоточное увеличение микроскопа до 1500х.
Фазово-контрастная микроскопия
Фазово-контрастная микроскопия (рис. 1) используется для получения высококонтрастных изображений прозрачных образцов, таких как живые клетки, микроорганизмы, тонкие кусочки ткани, литографические узоры, волокна, латексные дисперсии, осколки стекла и субклеточные частицы, включая ядра и другие органеллы. Метод контраста участка использует оптический механизм для того, чтобы перевести мельчайшие изменения в участке в соответствующие изменения в амплитуде, которые можно визуализировать как разницы в контрасте изображения. Одно из главных преимуществ микроскопии контраста участка в том, что живущие клетки можно рассмотреть в их естественном положении, без предварительного убийства. В результате динамика протекающих биологических процессов может наблюдаться и регистрироваться в высоком контрасте, с высокой четкостью мельчайших деталей образца.
Темнопольная микроскопия
Чтобы хорошо визуализировать эти биологические материалы, они должны иметь контраст, вызванный надлежащими показателями преломления, или окраску. Поскольку красители обычно токсичны, для достижения контраста может использоваться темная поляризационная микроскопия [2, 6]. В темнопольной микроскопии конденсатор предназначен для формирования «полого» конуса света (рис. 2). В темной микроскопии объектив находится в темной полости этого конуса, а свет распространяется вокруг объектива, но не входит в зону конуса. Все поле зрения кажется темным, но когда на предметный столик помещается образец, он кажется ярким на темном фоне. Он похож на заднее освещение объекта, который может быть того же цвета, что и фон, на котором он сидит, – чтобы он выделялся. Темнопольная микрокопия позволяет увидеть объекты, величина которых измеряется сотыми долями микрометра, что находится за пределами разрешающей способности обычного светлопольного микроскопа. Однако наблюдение за объектами в темном поле позволяет исследовать только контуры клеток и не дает возможности рассмотреть их внутреннюю структуру.
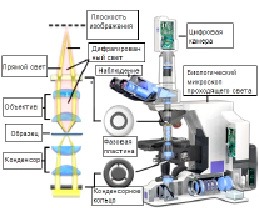
Рис. 1. Интернет: Stormoff, stormoff.ru, 2018
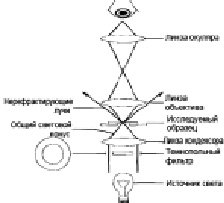
Рис. 2. Интернет: Studopedia, studopedia.ru, 2018
Лазерная конфокальная микроскопия
Конфокальная микроскопия (рис. 3) обладает такими особенностями, как контролируемая глубина резкости, устранение шумов вне фокуса и возможность сбора последовательных оптических секций из толстых образцов [5]. Конфокальная микроскопия основана на использовании пространственной фильтрации для устранения света вне фокуса и вспышки в образцах, которые толще плоскости фокусировки. Когда флуоресцентные образцы визуализируются с использованием обычного широкополосного оптического микроскопа, вторичная флуоресценция, испускаемая образцом вдали от интересующей области, часто мешает разрешению тех объектов, которые находятся в фокусе. Конфокальный метод визуализации обеспечивает незначительное улучшение как в осевом, так и в поперечном разрешении, но также обладает способностью исключить из изображения вспышку «вторичную флуоресценцию», которая возникает в густых флуоресцентно меченых образцах. Эта особенность вызвала большой рост популярности конфокальных микроскопов. Освещение достигается путем сканирования одного или нескольких фокусированных лучей света, обычно от лазера. Изображения, полученные путем сканирования образца таким образом, называются оптическими сечениями.
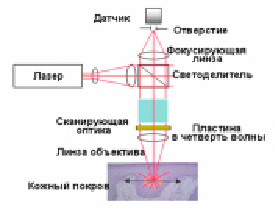
Рис. 3. Интернет: 5fan, 5fan.ru, 2018
Мультифотонная микроскопия
Мультифотонная микроскопия схожа с конфокальной и обеспечивает четкие преимущества для трехмерной визуализации [6]. Она хорошо подходит для визуализации живых клеток, особенно в интактных тканях, таких как срезы мозга, эмбрионы, а так же целые органы или небольшие организмы. Эффективная чувствительность флуоресцентной микроскопии, особенно при работе с толстыми образцами, как правило, ограничена вспышкой без фокуса. Это ограничение значительно сокращается в конфокальном микроскопе, с помощью конфокального отверстия для отклонения фоновой флуоресценции фокуса и получения несжатых оптических секций менее 1 микрометра. Мультифотонная микроскопия имеет преимущества: 1. Вследствие значительно меньшего поглощения тканей и клеток в ИК – области по сравнению с УФ, уменьшается повреждение живых клеток фотоиндуцированными процессами. 2. Достигается большая глубина проникновения излучения в биологические объекты. 3. Отсутствует возбуждение и выцветание флуорохромов вне фокального микрообъема, поэтому конфокальная диафрагма не требуется.
Заключение
Эпоха, когда оптическая микроскопия была чисто описательным инструментом прошла. В настоящее время формирование оптического изображения является лишь первым шагом к анализу данных. Микроскоп выполняет этот первый шаг в сочетании с электронными детекторами, процессорами изображений и устройствами отображения, которые можно рассматривать как расширения системы формирования изображения. Компьютеризированное управление фокусом, сценическим положением, оптическими компонентами, ставнями, фильтрами и детекторами широко распространено и позволяет проводить экспериментальные манипуляции, которые невозможны для человека при использовании механических микроскопов. Возрастающее применение электрооптики в флуоресцентной микроскопии привело к созданию оптических пинцетов, способных манипулировать субклеточными структурами или частицами, изображениями отдельных молекул и широким спектром сложных спектроскопических приложений.


 science-review.ru
science-review.ru