Род дымянка (Fumaria) сем. Fumariaceae представлен около 46 видами, наибольшее значение имеет дымянка лекарственная (F. officinalis L.).Она представляет собой однолетнее травянистое растениес прямостоячим ветвистым стеблем, высотой 20-40 см. Распространено повсеместно в Европейской части России, Кавказе, во всех районах Западной и Восточной Сибири. Растение сорное в посевах в районах северной и центральной лесостепи, растет у дорог и населенных пунктах [1].
Согласно литературным данным химический состав надземной части дымянки лекарственной представлен фенолкарбоновыми (кофейная, хлорогеновая) кислотами, фумаровой кислотой, флавоноидами до 1 % (рутин, кверцетин), алкалоидами изохинолинового ряда до 1,6 % [1]. Ее применение в официальной медицине связано с наличием алкалоидов, производных изохинолина (протропина, фумарилина и др.), обладающих гепатопротекторной, спазмолитической и анальгезирующей активностью. Экстракт дымянки входит в состав лекарственного средства «Гепабене»®. Сырье дымянки лекарственной –Fumitory – включено в Европейскую и Британскую Фармакопеи.
В последнее время появились сообщения о противоэкзематической и противовоспалительной активности экстрактов F. indica и F. рarviflora, основанной на комплексном действии суммы полифенольных соединений (флавоноиды, дубильные вещества и др.), алкалоидов и фумаровой кислоты [2, 3]. В этой связи обоснован интерес к изучению дымянки лекарственной в целях получения новых фитопрепаратов для лечения дерматологических заболеваний.
Цель данного исследования заключалась в изучении качественного и количественного состава БАС травы дымянки лекарственной, обладающих противовоспалительной активностью.
Материалы и методы исследования
Материалом для исследования служила трава дымянки лекарственной, собранная в фазу цветения в июле-августе 2017 года в окрестностях г. Кемерово. Растительное сырье собирали в сухую, ясную погоду и сушили до воздушно-сухого состояния. Сырье упаковывали в пакеты из крафт-бумаги и хранили в сухом прохладном месте. Сырье представляет собой смесь цельных кусочков или частично измельченных веточек, листьев, кусочков стеблей толщиной до 0,3 мм и цветков. Образцы измельчали до размера частиц, проходящих сквозь сито с диаметром отверстий 2 мм.
Для проведения идентификации БАС получены водные и водно-спиртовые извлечения 40 % и 70 % растворами этанола. Водные извлечения использовали для выделениясуммы дубильных веществ методом колоночной хроматографии [4] и последующей идентификации, водно-спиртовые извлечения – для определения флавоноидов[5]. Фумаровую кислоту из растительного сырья экстрагировали 95 % этанолом в соотношении 1:5 при нагревании на водяной бане в течение 30 минут.
Фракцию, содержащую алкалоиды, получали экстракцией 5,0 г измельченного сырья 5 мл разбавленного аммиака и 50 мл хлороформа в течение 15 минут. Хлороформное извлечение подкисляли 5 мл 5 % раствора серной кислоты, водный слой отделяли и использовали для качественных реакций на алкалоиды.
Фитохимический анализ проводили общепринятыми методами [6].
ТСХ выполняли на пластинах Sorbfil ПТСХ-АФ-А. Использовали денситометр с осветительной камерой Сорбфил КС 4.00.000 в условиях освещения лампами DULUX 7W/21 840 OSRAM (белого света) с системой фотофиксации Sony (HandycamHDR-CX405) и ТВ тюнером EasyCap (ООО «ИМИД», Россия). Обработку изображения осуществляли с применением ПОSorbfilTLCView. Элюция осуществлялась в системах растворителей: для агликонов флавоноидов: толуол-этилацетат-ледяная уксусная кислота (70:25:5); для гликозидов флавоноидов: этилацетат-ледяная уксусная кислота-вода (5:1:1); для фумаровой кислоты: муравьиная кислота-хлороформ-бутанол-гептан (12:16:32:44); для алкалоидов изохинолинового ряда: хлороформ-метанол (8:2). Аппликацию стандартного раствора на линию старта осуществляли с помощью микрошприца МШ-10 (ООО Цвет, Дзержинск, Россия) используя объем нанесения 2,5-17,5 мкл применяя аппликатор механический Sorbfil совместно используя нагревательное устройство УСП-1. Проявление зон адсорбции осуществляли следующими способами: просматривали в УФ-свете и отмечали собственную флуоресценцию соединений; просматривали в видимом и УФ-свете после обработки 5 % спиртовым раствором алюминия хлорида (флавоноиды); обрабатывали 1 % спиртовым раствором метилового красного (фумаровая кислота); просматривали в видимом и УФ-свете после обработки реактивом Драгендорфа.
Для количественного определения дубильных веществ в водном извлечении из травы дымянки лекарственной использовали перманганатометрическое титрование и спектрофотометрический метод (метод Folin-Ciokalteu), основанный на восстановлении смеси фосфорновольфрамовой и фосфорномолибденовой кислот в щелочной среде по методикам 1 и 2 ОФС.1.5.3.0008.15 «Определение содержания дубильных веществ в лекарственном растительном сырье и лекарственных растительных препаратах». Расчет количественного содержания суммы полифенольных соединений проведен в пересчете на галловую кислоту. Измерения проводили на фотоэлектроколориметре КФК-3 (Россия).
УФ-спектры снимали на спектрофотометре СФ-2000 (Россия). Все измерения выполнены в трехкратной повторности. Статистическую обработку результатов измерения проводили согласно требованиям ОФС.1.1.0013.15 «Статистическая обработка результатов эксперимента».
Результаты исследования и их обсуждение
При проведении качественных реакций в водном извлечении травы дымянки лекарственной установлено, что при взаимодействии с 1 % раствором желатина появлялась опалесценция, исчезающая от избытка реактива; с 1 % раствором хинина гидрохлорида возника ламорфный осадок; с 1 % раствором железоаммониевыхквасцов – черно-синее окрашивание (гидролизуемые дубильные вещества) и осадок; при добавлении смеси разведенной хлористоводородной кислоты и 40 % раствора формальдегида после кипячения осадок не образуется; с 10 % раствором уксусной кислоты и 10 % раствором средней соли свинца ацетатаобразуется осадок (гидролизуемые дубильные вещества), осадок отфильтровывали, к фильтрату добавляли 1 % раствор железоаммониевых квасцов и 0,1 г свинца ацетата – черно-синее окрашивание (гидролизуемые дубильные вещества); в извлечение прибавляли натрия нитрат и 0,1 М кислоты хлористоводородной – бурое окрашивание (гидролизуемые дубильные вещества). На основании проведенных качественных реакций в исследуемом извлечении травы дымянки обнаружена группа дубильных веществ гидролизуемого типа.
Количественное содержание суммы дубильных веществ, определенное методом перманганатометрии составило 3,955 ± 0,49 %, спектрофотометрическим методом Folin-Ciokalteu – 2,80 ± 0,017 %.
На основании проведенных качественных реакций сделано предположение о наличии в водно-спиртовом извлечении травы дымянки лекарственной флавоноидов, представленных группой флавонов, флавонолов, 5-оксифлавонолов и 5-оксифлавонов (таблица).
Результаты качественных реакций на флавоноиды в водно-спиртовом извлечении травы дымянки лекарственной
|
Реакция |
Эффект реакции для различных групп флавоноидов |
Эффект |
|
Цианидиновая проба |
Флавонолы, флавоны, флавононы– красное или оранжевое окрашивание |
Оранжевое окрашивание |
|
Реакция по Брианту |
Агликоны флавонолов, флавонлов, флавононов – красное или оранжевое окрашивание слоя октилового спирта |
Оранжевое окрашивание слоя октилового спирта |
|
Реакция с раствором NaOH |
Флавоны и флавонолы – желтое окрашивание |
Желтое окрашивание |
|
Реакция с реактивом Вильсона |
5-оксифлавоны, 5-оксифлавонолы – ярко-желтое окрашивание с красноватой флуоресценцией |
Желтое окрашивание с красноватой флуоресценцией |
|
Реакция с 5 % раствором алюминия хлорида |
Флавоны, флавонолы, халконы – желтое окрашивание с ярко-желтой флуоресценцией |
Желтое окрашивание и характерная флуоресценция |
В результате проведения хроматографии в тонких слоях сорбента (ТСХ) в системе для гликозидов флавоноидов после обработки 5 % раствором AlCl3обнаружено 6 зон адсорбции имеющих ярко-желтую флуоресценцию. Зона адсорбции с Rf-0,45 совпала с РСО рутина. Для определения агликонов флавоноидов, содержащихся в извлечении травы дымянки, использовали подвижную фазу толуол-этилацетат-ледяная уксусная кислота (70:25:5). На хроматограмме после обработки 5 % раствором AlCl3 присутствуют 5 зон адсорбции с зеленовато-желтой флуоресценцией в УФ-свете. Зона адсорбции с Rf-0,27 совпадает с РСО кверцетина.
В УФ-спектре 70 % водно-спиртового извлечения из травы дымянки наблюдалось два максимума поглощения при λ = 288 и 324 нм, характерных для флавонов и флавонолов. При использовании шифт-пробы с раствором алюминия хлорида наблюдался батохромный сдвиг второй полосы поглощения на 91 нм, что свидетельствует о наличии свободной гидроксильной группы в 5 положении флавонов и флавонолов.
Хроматография спиртового извлечения из травы дымянки лекарственной в системе растворителей муравьиная кислота-хлороформ-бутанол-гептан (12:16:32:44) после проявления 1 % спиртовым раствором метилового красного показала наличие фумаровой кислоты (Rf-0,87).
В извлечении из травы дымянки лекарственной с помощью осадительных реактивов подтверждено наличие алкалоидов. При взаимодействии с 1 % раствором танина появлялась желтоватая опалесценция, исчезающая от избытка реактива; с реактивом Драгендорфа возникал оранжевый осадок; с реактивом Вагнера-Бушарда – бурый осадок; с 1 % раствором пикриновой кислоты – желтый кристаллический осадок; при добавлении раствора фосфорно-вольфрамовойкислоты выпадал беловатый аморфный осадок.
Из литературных данных известно, что алкалоиды дымянки лекарственной по химической структуре относятся к алкалоидам изохинолинового ряда (рис. 1), обладающим выраженной противовоспалительной активностью [7].
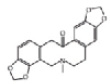
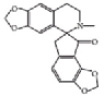
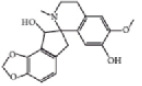
Протропин Фумарилин Фумаритин
Рис. 1. Структура алкалоидов, выделенных из травы дымянки лекарственной [1]

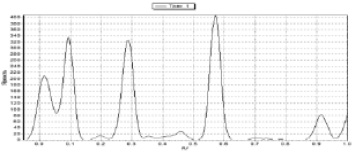
Рис. 2. Хроматограмма извлечения из травы дымянки лекарственной и профиль ее денситометрического сканирования после обработки реактивом Драгендорфа в УФ-свете при λ = 366 нм
Нами была изучена возможность использования специальных реактивов для идентификации данной группы алкалоидов. При взаимодействии с концентрированной серной кислотой при нагревании наблюдалось фиолетовое окрашивание; с концентрированной азотной кислотой появлялось желтое окрашивание; при добавлении реактива Эрдмана – сине-фиолетовое окрашивание при нагревании; с реактивом Марки наблюдали образование оранжево-красного окрашивания; реактив Манделина окрашивал извлечение в сине-зеленый цвет.
Хроматографическое разделение извлечения, полученного для определения алкалоидов травы дымянки, проводили методом ТСХ. Результаты оценивали до и после обработки реактивом Драгендорфа при просмотре в УФ – свете c применением программной обработки сканированных изображений хроматограмм с помощью компьютерной программы SorbfilTLCView[8]. На хроматограмме обнаружено 4 доминирующих зоныадсорбции алкалоидов, окрашенные в оранжево-красный цвет, с Rf 0,02; 0,09; 0,29 и 0,57 (рис. 2).
Таким образом, в результате проведенного исследования, подтверждено наличие основных групп БАС травы дымянки лекарственной, проявляющих противовоспалительную активность – флавоноиды, дубильные вещества, фумаровая кислота и алкалоиды изохинолинового ряда. Перспективным для получения фитопрепатратов противовоспалительного действия на основе травы дымянки является использование экстрагентов с высоким содержанием этанола, позволяющих получить весь спектр БАС дымянки и максимально повысить фармакологическое действие.


 science-review.ru
science-review.ru