Канцерогенез является сложным патофизиологическим процессом возникновения и развития опухоли. В последние годы широкое признание получила свободно-радикальная теория канцерогенеза.
Активные формы кислорода (АФК) – это группа свободно-радикальных молекул, являющихся частично восстановленными производными кислорода, обладающих очень мощной окислительной способностью. К ним относятся: супероксидный анион-радикал (O2-), перекись водорода (Н2O2), гидроксильный радикал (ОН·), синглетный кислород (′O2), гипогалоиды и другие. Зачастую они являются побочными продуктами работы дыхательной цепи – группы митохондриальных белков, утилизирующих кислород и непрерывно поставляющих клетке энергию в форме АТФ. Системы образования АФК возникают во всех отделах клетки спонтанно или с участием ферментов. Существенный вклад в этот процесс вносит дыхательная цепь митохондрий при низкой концентрации АДФ. Важную роль играет цитохром Р-450, локализованный в эндоплазматической сети. Также АФК вырабатывается ферментами с участием NADPH в плазматической мембране фагоцитов [1].
АФК необходимы для иммунной защиты, так как усиливают синтез цитокинов и иммунных рецепторов, способствуют выходу лейкоцитов в ткани, лизируют фагоцитированные бактерии, подавляют синтез ДНК и деление клеток и могут активировать апоптоз, что предупреждает прогрессирование опухолевых процессов .
АФК, вызывая генетические мутации, играют существенную роль на всех этапах канцерогенеза. Считается, что они вызывают мутаций больше, чем алкилирующие вещества. Действие АФК заключается в повреждении хроматина, ДНК, клеточных мембран, кальциевых каналов, что вызывает нарушение поступления кальция в клетку. Наиболее реактивная форма АФК – ОН·-радикал вызывает разрывы цепей ДНК, повреждение хромосом, что, в свою очередь, запускают механизмы повреждения и гибели клеток, а также их злокачественного перерождения. Мутации под действием АФК в половых клетках, служат источником наследуемых онкологических заболеваний [2].
При реакции АФК с ненасыщенными жирными кислотами плазматических мембран происходит перекисное окисление липидов (ПОЛ) – свободно-радикальный процесс, постоянно протекающий в организме. В норме он поддерживается на определенном уровне.
Активация ПОЛ характерна при таком патологическом состоянии как канцерогенез, который является многоступенчатым процессом накопления мутаций и других генетических изменений, приводящих к развитию разнообразных форм рака .
При избыточной концентрации АФК повреждают клетки и способствуют развитию острых воспалительных и злокачественных процессов. Высвобождение АФК в ходе «респираторного взрыва « происходит в фагосомы и в окружающую среду, при этом бактериальные клетки теряют свою биологическую активность ,также при этом могут повреждаться сами фагоциты и здоровые нормальные ткани.
При чрезмерном накоплении АФК, пероксидов и окисленных продуктов происходит окислительный стресс, который способствует разрушению фагоцитируемого обьекта. В этом случае АФК выделяются во внешнюю среду. Это универсальный эффекторный механизм фагоцита. Окислительный стресс приводит к повреждению наиболее важных биологических молекул – нуклеиновых кислот, белков, липидов. В настоящее время окислительный стресс в организме рассматривается как универсальный неспецифический механизм инициации опухолевого роста [3].
Получая сигнал от лимфоцита, с помощью антител, взаимодействующих с Fc-рецепторами фагоцита, процесс окислительного стресса осуществляет антителозависимую цитотоксичность. Активация фагоцитов заключается в повышении проницаемости цитоплазматической мембраны и перестройке клеточного метаболизма, опосредованной повышением внутриклеточной концентрации ионов кальция, активированием аденилатциклазы и протеинкиназы С. В активированных фагоцитах значительно усиливается окисление глюкозы по апотомическому пути (пентозофосфатный цикл) и резко (в десятки раз) усиливается потребление кислорода. Последнее обстоятельство, а также внезапность и скорость, с которой возникают и развиваются эти реакции, послужили основанием для того, чтобы назвать это явление «респираторным « взрывом – одним из универсальных проявлений реактивности фагоцитирующих клеток. Основной механизм сводится к активации фагоцитов в результате контакта плазматической мембраны с опухолевой клеткой, что стимулирует активность цитоплазматического ферментного комплекса NADPH-оксидазы, который катализирует перенос электронов с NADPH на молекулярный кислород с образованием супероксидного анион-радикала [4].
NADPH-оксидаза представляет собой мультикомпонентную систему, состоящую из мембраносвязанных и цитозольных компонентов. В ее состав входят два интегральных мембранных белка, четыре цитозольных белка: р40рhox, р47phoх , р67phox и гуанин-нуклеотидсвязывающий белок Rac2. Фермент локализован на мембране таким образом, что NADPH-связывающий центр направлен внутрь клетки, а супероксиданион-связывающий центр расположен на внешней стороне мембраны. В результате молекулярный кислород восстанавливается на внутренней поверхности мембраны, а супероксидный анион-радикал выделяется в среду окружающую фагоцит. Убыль NADPH по механизму обратной связи стимулирует пентозофосфатный цикл окисления глюкозы, восполняющий фонд НАДФН [5].
Сборка и активация комплекса NADPH оксидазы происходит следующим образом:
Стимуляция нейтрофила вызывает переход Rac в активную форму и фосфорилирование цитозольных компонентов p47phox и p67phox. Эти субъединицы транслоцируются к мембране и связываются с р22рhox и gp91phox, что инициирует продукцию АФК.
Субъединицы р22рhох и gp91рhох образуют гетеродимерный флавопротеин, известный как цитохром b558 , который локализован в мембранах секреторных везикул и специфических гранул. Субъединица gp91phoх является гликозилированной р-субъединицей цитохрома b558, р22рhох: -а-субъединицей. Стабильность каждой субъединицы флавоцитохрома b зависит от гетеродимерной формации таким образом, что мутации как gp91phoх так и p22phox приводят к отсутствию обоих субъединиц на клеточной поверхности.
Цитохром fe558 содержит одну молекулу флавина и два гема, которые образуют электронно-транспортную цепь NADPH оксидазы. Экспериментально показано, что цитохром Ь558 способен генерировать 0~2 в отсутствии других компонентов NADPH оксидазы [5].
Белок gp91phox рассматривается как член семейства NOX-белков, которые экспрессируются в нефагоцитирующих клетках, и имеют множество функций, не относящихся к антимикробной активности .
Цитозольный компонент p47phox состоит из 390 аминокислот. Он содержит два SH3 мотива, один обогащенный пролином регион и один РХ домен (плекстрин-гомологичный домен). РХ-домен специфически взаимодействует с инозитолфосфатидами, в частности, с фосфатидилинозит-3,4–дифосфатом, что важно для удержания p47phох в примембранной области. SH3 мотивы и обогащенный пролином домен также участвуют во взаимодействии с цитохромом b558 и p67phox. Во время активации NADPH оксидазы p47phox связывается с цитохромом b558, обеспечивая транслокацию цитозольного комплекса p40phox – p47phox – p67phox из цитозоля к мембране. Этот процесс не происходит без множественного фосфорилирования р47рhох . Показано, что р47рhох является наиболее фосфорилированной субъединицей NADPH оксидазы, имеющей 11 сайтов фосфорилирования . Известно, что p47phox является субстратом ПКС, MAPKs, РКА, р21–активируемой киназы, ФИ-З-К для фосфорилирования in vitro. Какой из этих ферментов фосфорилирует in vivo и по какому сайту, остается неизвестным. Подобно p47phox, p22phox и p67phox также фосфорилируются при активации клетки, хотя функциональная значимость фосфорилирования не известна [6].
Субъединица p67phox состоит из 526 аминокислот, содержит два SH3 домена: пролин-обогащенный и связывающий NADPH. Белок p67phox тесно взаимодействует с цитоскелетом и фосфорилируется во время стимуляции нейтрофила, но в меньшей степени, чем p47phox. Эта субъединица взаимодействует с Rac2 и с цитохромом Ь558 и регулирует каталитическую активность NADPH оксидазы через последовательность, называемую «активный домен « «Активный домен» (200–210 аминокислот) необходим для активации переноса электрона через флавоцитохром b558 .
Субъединица p40phox состоит из 339 аминокислот, содержит один SH3 домен и один РХ домен. Белок слабо фосфорилируется при активации клетки и не является необходимым для сборки NADPH оксидазы. Функциональная роль белка p40phox до конца не определена, в экспериментах in vitro было показано как и его стимулирующее, так и ингибирующее действие на NADPH оксидазу. РХ домен специфично связывается с фосфатидилинозит-3–фосфатом, который накапливается в фагосомальных мембранах, что способствует удержанию NADPH оксидазного комплекса в мембране.
Структура и сборка NADPH-оксидазы показана на рисунке.
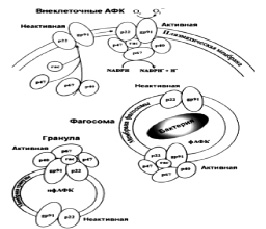
Структура и сборка NADPH-оксидазы
Цитохром b, состоящий из субъединиц gp91phox (NOX2; ген CYBB) и p22phox (ген CYBA), расположен в цитоплазматической мембране и мембранах внутриклеточных гранул. После активации цитозольные компоненты p47phox (NOXО2; NCF1), р67phox (NOXA2; NCF2), р40phox (NCF4) и Rac2 (Rac2) транслоцируются к цитохрому b с образованием функциональной NADPH-оксидазы. При активации NADPH оксидазы на плазматической мембране происходит образование внеклеточных АФК, а при активации ферментного комплекса на внутренних мембранах образуются внутриклеточные фагосомальные (фАФК) и нефагосомальные АФК (нфАФК), остающиеся внутри клетки. [7].
В настоящее время ведутся исследования, направленные на возможность использования в комплексной терапии онкологических заболеваний иммунокорригирующих препаратов, проявляющих антиокислительные свойства. Так, отмечены позитивные изменения в уровне АФК под действием соединений 3d-металлов с глюконовой кислотой, способствующих повышению активности антиоксидантных ферментов [8]. Показана взаимосвязь между показателями ПОЛ, окислительной модификации белка и развитием злокачественной опухоли у мышей с индуцированной миеломой [9].


 science-review.ru
science-review.ru